

نیروی انقباض هر طول واحد روی سطح مایع تنش سطح نامیده می شود و واحد N. · M-1 است.

خاصیت کاهش تنش سطحی حلال به فعالیت سطحی گفته می شود و ماده ای با این خاصیت یک ماده فعال سطح نامیده می شود.
ماده فعال سطح که می تواند مولکول ها را در محلول آبی متصل کند و میسل ها و سایر ارتباطات را تشکیل دهد و فعالیت سطح بالایی داشته باشد ، در حالی که اثر خیس شدن ، امولسیون ، کف ، شستشو و غیره نیز دارد.
سورفاکتانت ترکیبات آلی با ساختار و خاصیت خاص است که می تواند تنش بین سطحی بین دو مرحله یا تنش سطحی مایعات (به طور کلی آب) را با خیس شدن ، کف ، امولسیون ، شستشو و سایر خصوصیات تغییر دهد.
از نظر ساختار ، سورفاکتانت ها از ویژگی های مشترکی برخوردار هستند که در مولکول های خود دو گروه از طبیعت مختلف دارند. در یک انتها زنجیره ای طولانی از گروه غیر قطبی ، محلول در روغن و نامحلول در آب ، همچنین به عنوان گروه آبگریز یا گروه ضد آب شناخته می شود. چنین گروه ضد آب به طور کلی زنجیرهای طولانی هیدروکربن ها است ، گاهی اوقات برای فلورین آلی ، سیلیکون ، ارگانوفسفات ، زنجیره ارگانوتین و غیره نیز در انتهای دیگر گروه محلول در آب ، یک گروه آبگریز یا گروه معتبر روغن است. گروه آبگریز باید به اندازه کافی آبگریز باشد تا اطمینان حاصل شود که کل سورفاکتانت ها در آب محلول هستند و حلالیت لازم را دارند. از آنجا که سورفاکتانت ها حاوی گروه های آبگریز و آبگریز هستند ، حداقل در یکی از مراحل مایع می توانند محلول باشند. این خاصیت آبگریز و لیپوفیلیک سورفاکتانت به عنوان آمفیفیلیت نامیده می شود.


سورفاکتانت نوعی مولکول های آمفیفیلیک با هر دو گروه آبگریز و آبگریز است. گروه های آبگریز سورفاکتانت ها به طور کلی از هیدروکربن های زنجیره ای طولانی ، مانند آلکیل C8 ~ C20 با زنجیره مستقیم ، آلکیل C8 ~ C20 , آلکیل فنیل (Alkyl Carbon Tom 16 ~ 16) و مانند آن تشکیل شده اند. تفاوت بین گروههای آبگریز عمدتاً در تغییرات ساختاری زنجیره های هیدروکربن است. و انواع گروه های آبگریز بیشتر است ، بنابراین خواص سورفاکتانت ها علاوه بر اندازه و شکل گروه های آبگریز ، بیشتر مربوط به گروه های آبگریز است. تغییرات ساختاری گروههای آبگریز از گروههای آبگریز بزرگتر است ، بنابراین طبقه بندی سورفاکتانت ها به طور کلی مبتنی بر ساختار گروه های آبگریز است. این طبقه بندی مبتنی بر اینکه آیا گروه آبگریز یونی است یا خیر ، است و به انواع خاص سورفکتانتها به آنیونی ، کاتیونی ، غیر یونی ، زوییتونیک و سایر انواع خاص تقسیم می شود.

① جذب سورفاکتانت ها در interfac
مولکول های سورفاکتانت مولکول های آمفیفیلیک هستند که دارای گروه های لیپوفیلی و آبگریز هستند. هنگامی که سورفاکتانت در آب حل می شود ، گروه آبگریز آن به آب جذب می شود و در آب حل می شود ، در حالی که گروه لیپوفیلیک آن توسط آب دفع می شود و آب را ترک می کند و در نتیجه جذب مولکول های سورفاکتانت (یا یون ها) بر روی رابط دو فاز ایجاد می شود که باعث کاهش فشار بین بین دو فاز می شود. هرچه مولکول های سورفاکتانت (یا یونها) در رابط جذب شوند ، کاهش تنش بین سطحی بیشتر می شود.
② برخی از خصوصیات غشای جذب
فشار سطحی غشای جذب: جذب سورفاکتانت در رابط گاز مایع برای ایجاد یک غشای جذب ، مانند قرار دادن یک ورق شناور قابل جابجایی بدون اصطکاک بر روی رابط ، غشای شناور را در امتداد سطح محلول سوق می دهد و غشای فشار بر روی ورق سطح ایجاد می کند که به آن فشار سطح می رسد ، که به آن فشار سطح می رسد.
ویسکوزیته سطح: مانند فشار سطح ، ویسکوزیته سطح خاصیتی است که توسط غشای مولکولی نامحلول به نمایش گذاشته می شود. معلق با یک حلقه پلاتین سیم فلزی ریز ، به طوری که هواپیمای آن با سطح آب مخزن تماس می گیرد ، حلقه پلاتین ، حلقه پلاتین را با ویسکوزیته مانع آب ، دامنه به تدریج پوسیده می کند ، که براساس آن می توان ویسکوزیته سطح را اندازه گیری کرد. روش: ابتدا آزمایش بر روی سطح آب خالص برای اندازه گیری پوسیدگی دامنه انجام می شود ، و سپس پوسیدگی پس از تشکیل غشای سطحی اندازه گیری می شود و ویسکوزیته غشای سطحی از تفاوت بین این دو مشتق می شود.
ویسکوزیته سطح از نزدیک با استحکام غشای سطح ارتباط دارد و از آنجا که غشای جذب دارای فشار و ویسکوزیته سطح است ، باید خاصیت ارتجاعی داشته باشد. هرچه فشار سطح بالاتر باشد و ویسکوزیته غشای جذب شده بیشتر باشد ، مدول الاستیک آن بالاتر می رود. مدول الاستیک غشای جذب سطح در فرآیند تثبیت حباب مهم است.
③ تشکیل میسل
راه حل های رقیق کننده سورفاکتانت ها از قوانین پیروی می کنند که به دنبال آن راه حل های ایده آل است. مقدار سورفاکتانت که بر روی سطح محلول جذب می شود با غلظت محلول افزایش می یابد ، و هنگامی که غلظت به مقدار مشخصی برسد یا فراتر رود ، مقدار جذب دیگر افزایش نمی یابد و این مولکول های سورفاکتانت اضافی به روش هافازارد یا به نوعی منظم در محلول هستند. هر دو تمرین و تئوری نشان می دهد که آنها در راه حل ارتباط برقرار می کنند و این انجمن ها میسل نامیده می شوند.
غلظت میسل بحرانی (CMC): حداقل غلظت که در آن سورفاکتانت ها میسل را در محلول تشکیل می دهند ، غلظت میسل بحرانی نامیده می شود.
مقادیر CMC از سورفاکتانتهای مشترک.

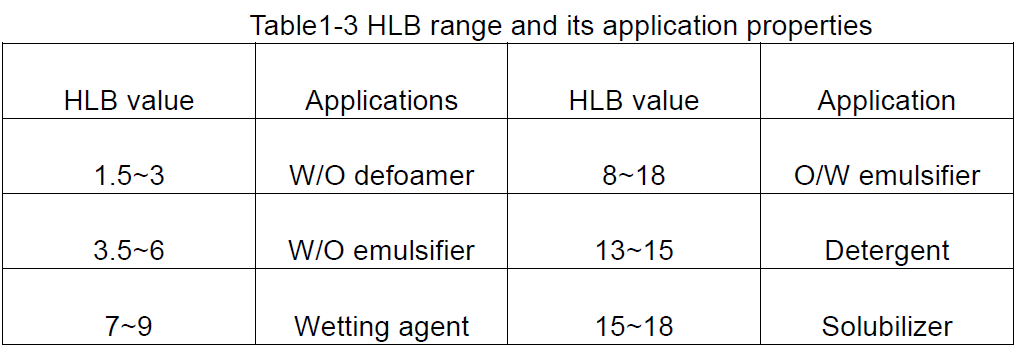
HLB مخفف تعادل لیپوفیل هیدروفیل است که نشانگر تعادل آبگریز و لیپوفیلی گروههای آبگریز و لیپوفیلی سورفاکتانت ، یعنی ، مقدار HLB سورفاکتانت است. مقدار HLB بزرگ نشان دهنده یک مولکول با آبگریز قوی و لیپوفیلی ضعیف است. در مقابل ، لیپوفیلی قوی و آبگریز ضعیف.
① مفاد ارزش HLB
مقدار HLB یک مقدار نسبی است ، بنابراین وقتی مقدار HLB توسعه می یابد ، به عنوان یک استاندارد ، مقدار HLB موم پارافین ، که هیچ خاصیت آبگریز ندارد ، مشخص شده است که 0 است ، در حالی که مقدار HLB سدیم سولفات سدیم ، که بیشتر محلول در آب است ، 40 است. لیپوفیلیک ، در حالی که افراد بیشتر از 10 عدد آبگریز هستند. بنابراین ، نقطه عطف از لیپوفیلی تا آبگریز حدود 10 است.
بر اساس مقادیر HLB سورفاکتانت ها ، همانطور که در جدول 1-3 نشان داده شده است ، می توان یک ایده کلی از کاربردهای احتمالی آنها بدست آورد.

دو مایعات نامحلول متقابل ، یکی در دیگری به عنوان ذرات (قطرات یا کریستال های مایع) پراکنده شده است ، سیستمی به نام امولسیون را تشکیل می دهند. این سیستم به دلیل افزایش منطقه مرزی دو مایعات هنگام تشکیل امولسیون ، از نظر ترمودینامیکی ناپایدار است. به منظور پایداری امولسیون ، لازم است یک مؤلفه سوم - امولسیفایر برای کاهش انرژی سطحی سیستم اضافه شود. امولسیفایر متعلق به سورفاکتانت است ، عملکرد اصلی آن ایفای نقش امولسیون است. مرحله امولسیون که به عنوان قطرات وجود دارد ، فاز پراکنده (یا فاز داخلی ، فاز ناپیوسته) نامیده می شود و مرحله دیگر که به هم پیوند داده می شود ، محیط پراکندگی (یا مرحله بیرونی ، مرحله مداوم) نامیده می شود.
① امولسیفرها و امولسیون ها
امولسیون های متداول ، یک مرحله آب یا محلول آبی است ، مرحله دیگر مواد آلی است که با آب قابل تصور نیست ، مانند گریس ، موم و غیره. امولسیون تشکیل شده توسط آب و روغن می تواند با توجه به وضعیت پراکندگی آنها به دو نوع تقسیم شود: روغن پراکنده شده در آب به شکل امولسیون روغن در آب ، بیان شده به عنوان O/W (روغن/آب): آب پراکنده شده در روغن): آب پراکنده شده از روغن تا آب به صورت روغن تا آب به صورت روغن): آب به صورت روغن): آب به صورت روغن و آب از آب پراکنده شده است: آب به صورت روغن): آب به صورت روغن): آب به صورت روغن و آب از آب استفاده می شود. (آب/روغن). آب/O/W آب در آب و روغن پیچیده و روغن در آب در روغن O/W/O نوع چند امولسیون نیز ممکن است تشکیل شود.
از امولسیفایر برای تثبیت امولسیون با کاهش تنش بین سطحی و تشکیل غشای بین سطحی تک مولکول استفاده می شود.
در امولسیون الزامات امولسیفایر:
پاسخ: امولسیفایر باید بتواند رابط بین دو مرحله را جذب یا غنی سازد ، به طوری که تنش سطحی کاهش می یابد.
ب: امولسیفایر باید ذرات را به بار خود ببخشد ، به طوری که دفع الکترواستاتیک بین ذرات یا یک غشای محافظ پایدار و بسیار چسبناک در اطراف ذرات تشکیل می دهد.
بنابراین ، ماده مورد استفاده به عنوان یک امولسیفایر باید برای امولسیون سازی دارای گروه های آمورفیلیک باشد و سورفاکتانت ها می توانند این نیاز را برآورده کنند.
② روشهای آماده سازی امولسیون ها و عوامل مؤثر بر ثبات امولسیون ها
دو روش برای تهیه امولسیون وجود دارد: یکی استفاده از روش مکانیکی برای پراکندگی مایع در ذرات ریز در مایع دیگر است که بیشتر در صنعت برای تهیه امولسیون استفاده می شود. مورد دیگر این است که مایع را در حالت مولکولی در مایع دیگر حل کنید و سپس آن را به درستی جمع کنید تا امولسیون ها تشکیل شود.
پایداری یک امولسیون توانایی تجمع ضد ذرات است که منجر به جداسازی فاز می شود. امولسیون ها سیستم های ترمودینامیکی ناپایدار با انرژی آزاد بزرگ هستند. بنابراین ، به اصطلاح پایداری یک امولسیون در واقع زمان لازم برای رسیدن به تعادل ، یعنی زمان لازم برای جداسازی یکی از مایعات موجود در سیستم است.
هنگامی که غشای سطحی با الکل های چرب ، اسیدهای چرب و آمین های چرب و سایر مولکول های آلی قطبی ، استحکام غشای به طور قابل توجهی بالاتر است. این امر به این دلیل است که ، در لایه جذب سطحی مولکول ها و الکل های امولسیفایر ، اسیدها و آمین ها و سایر مولکول های قطبی برای تشکیل "پیچیده" ، به طوری که قدرت غشای سطحی افزایش می یابد.
امولسیفایرهای متشکل از بیش از دو سورفاکتانت به عنوان امولسیفایرهای مختلط نامیده می شوند. امولسیفایر مخلوط در رابط آب/روغن جذب می شود. عمل بین مولکولی می تواند مجتمع ها را تشکیل دهد. با توجه به عملکرد قوی بین مولکولی ، تنش بین سطحی به طور قابل توجهی کاهش می یابد ، میزان جذب امولسیفایر در رابط به طور قابل توجهی افزایش می یابد ، تشکیل چگالی غشای سطحی افزایش می یابد ، قدرت افزایش می یابد.
بار دانه های مایع تأثیر معنی داری بر پایداری امولسیون دارد. امولسیون پایدار ، که مهره های مایع آن به طور کلی شارژ می شوند. هنگامی که از امولسیفایر یونی استفاده می شود ، یون امولسیفایر جذب شده در رابط دارای گروه لیپوفیلیک خود است که در فاز روغن درج شده و گروه آبگریز در فاز آب قرار دارد ، بنابراین مهره های مایع را شارژ می کند. همانطور که مهره های امولسیون با همان بار ، آنها یکدیگر را دفع می کنند ، جمع آوری آسان نیست ، به طوری که ثبات افزایش می یابد. مشاهده می شود که هرچه یونهای امولسیفایر بیشتر بر روی مهره ها جذب می شوند ، بار نیز بیشتر می شود ، توانایی جلوگیری از انباشتگی مهره ها بیشتر می شود ، سیستم امولسیون پایدارتر خواهد بود.
ویسکوزیته محیط پراکندگی امولسیون تأثیر مشخصی در پایداری امولسیون دارد. به طور کلی ، هرچه ویسکوزیته محیط پراکندگی بیشتر باشد ، ثبات امولسیون بیشتر می شود. این امر به این دلیل است که ویسکوزیته محیط پراکندگی بسیار زیاد است ، که تأثیر شدیدی بر حرکت براون مهره های مایع دارد و برخورد بین دانه های مایع را کند می کند ، به طوری که سیستم پایدار باقی می ماند. معمولاً مواد پلیمری که می توانند در امولسیون ها حل شوند می توانند ویسکوزیته سیستم را افزایش داده و پایداری امولسیون ها را بیشتر کنند. علاوه بر این ، پلیمرها همچنین می توانند یک غشای بین سطحی قوی تشکیل دهند و سیستم امولسیون را پایدار تر می کند.
در بعضی موارد ، افزودن پودر جامد همچنین می تواند باعث تثبیت امولسیون شود. پودر جامد بسته به روغن ، روغن یا رابط در آب ، روغن یا رابط است ، اگر پودر جامد با آب کاملاً مرطوب نباشد ، اما از طریق روغن نیز مرطوب باشد ، روی آب و رابط روغن باقی می ماند.
پودر جامد امولسیون را پایدار نمی کند زیرا پودر جمع آوری شده در رابط باعث تقویت غشای سطحی می شود ، که شبیه به جذب سطحی مولکول های امولسیفایر است ، بنابراین هرچه بیشتر مواد پودر جامد در رابط چیده می شوند ، امولسیون پایدار تر است.
سورفاکتانت ها می توانند پس از تشکیل میسل در محلول آبی ، حلالیت مواد آلی محلول در محلول یا کمی محلول در آب را افزایش دهند و محلول در این زمان شفاف است. این اثر میسل را حل می کند. سورفاکتانت که می تواند حلالیت ایجاد کند ، حل کننده نامیده می شود و ماده آلی که حل شده است ، ماده حل شده نامیده می شود.

فوم نقش مهمی در روند شستشو دارد. فوم یک سیستم پراکندگی است که در آن یک گاز در یک مایع یا جامد پراکنده می شود ، با گاز به عنوان فاز پراکنده و مایع یا جامد به عنوان محیط پراکندگی ، اولی که فوم مایع نامیده می شود ، در حالی که دومی به عنوان فوم جامد ، مانند پلاستیک کف ، شیشه فوم ، سیمان فوم و غیره نامیده می شود.
(1) تشکیل کف
منظور ما از فوم است که در اینجا جمع حباب های هوا توسط یک غشای مایع از هم جدا شده است. این نوع حباب همیشه به دلیل تفاوت زیاد چگالی بین فاز پراکنده (گاز) و محیط پراکندگی (مایع) ، به سرعت به سطح مایع می رسد ، همراه با ویسکوزیته کم مایع.
فرآیند تشکیل حباب این است که مقدار زیادی گاز را به داخل مایع وارد کنید و حباب های موجود در مایع به سرعت به سطح باز می گردند و یک کل حباب ها را با مقدار کمی از گاز مایع جدا می کنند.
فوم از نظر مورفولوژی دارای دو ویژگی مهم است: یکی این که حباب ها به عنوان یک مرحله پراکنده اغلب به شکل چند قطبی هستند ، به این دلیل است که در تقاطع حباب ها ، تمایل به فیلم مایع نازک به طوری وجود دارد که حباب ها به صورت چندگانه تبدیل می شوند ، هنگامی که فیلم مایع به اندازه معینی می شود ، منجر به پارگی حباب می شود. دوم این است که مایعات خالص نمی توانند کف پایدار تشکیل دهند ، مایعی که می تواند کف تشکیل شود حداقل دو یا چند مؤلفه است. محلول های آبی سورفاکتانت ها معمولی برای سیستم هایی هستند که مستعد تولید کف هستند و توانایی آنها در تولید کف نیز به سایر خصوصیات مربوط می شود.
سورفاکتانت ها با قدرت کف مناسب به عنوان عوامل کف سازی نامیده می شوند. اگرچه ماده کف سازی توانایی کف خوبی دارد ، اما کف تشکیل شده ممکن است قادر به حفظ مدت طولانی نباشد ، یعنی ثبات آن لزوماً خوب نیست. به منظور حفظ پایداری کف ، اغلب در ماده کف سازی برای اضافه کردن موادی که می تواند پایداری کف را افزایش دهد ، این ماده به عنوان تثبیت کننده کف نامیده می شود ، که معمولاً تثبیت کننده استفاده می شود لوریل دی اتانول آمین و Dodecyl Dimethylamine اکسید است.
(2) ثبات کف
فوم یک سیستم ترمودینامیکی ناپایدار است و روند نهایی این است که کل سطح مایع موجود در سیستم پس از شکسته شدن حباب کاهش می یابد و انرژی آزاد کاهش می یابد. فرآیند defoaming فرایندی است که توسط آن غشای مایع که گاز را جدا می کند ضخیم تر و نازک تر می شود تا زمانی که شکسته شود. بنابراین ، درجه پایداری کف عمدتاً با سرعت تخلیه مایع و استحکام فیلم مایع تعیین می شود. عوامل زیر نیز بر این امر تأثیر می گذارد.
(3) تخریب کف
اصل اساسی تخریب کف ، تغییر شرایطی است که باعث تولید کف یا از بین بردن فاکتورهای تثبیت کننده کف می شود ، بنابراین روش های فیزیکی و شیمیایی برای خنثی سازی وجود دارد.
خنثی سازی فیزیکی به معنای تغییر شرایط تولید کف در حالی است که ترکیب شیمیایی محلول فوم مانند اختلالات خارجی ، تغییر در دما یا فشار و درمان اولتراسونیک همه روشهای فیزیکی مؤثر برای از بین بردن کف هستند.
روش خنثی سازی شیمیایی اضافه کردن مواد خاصی برای تعامل با ماده کف کننده برای کاهش استحکام فیلم مایع در کف و در نتیجه کاهش پایداری کف برای دستیابی به هدف دفع کننده است ، چنین موادی را defoamers نامیده می شود. بیشتر defoamers سورفاکتانت ها هستند. بنابراین ، با توجه به مکانیسم defoaming ، Defoamer باید از توانایی قوی در کاهش تنش سطح ، جذب آسان بر روی سطح برخوردار باشد و تعامل بین مولکول های جذب سطح ضعیف است ، مولکولهای جذب شده در یک ساختار سست تر.
انواع مختلفی از defoamer وجود دارد ، اما اساساً ، همه آنها سورفاکتانت های غیر یونی هستند. سورفاکتانتهای غیر یونی دارای خواص ضد کفگی در نزدیکی یا بالاتر از نقطه ابر خود هستند و اغلب به عنوان defoamers استفاده می شوند. الکل ها ، به ویژه الکلهایی با ساختار انشعاب ، اسیدهای چرب و استرهای اسید چرب ، پلی آمیدها ، استرهای فسفات ، روغنهای سیلیکون و غیره نیز معمولاً به عنوان دفع کننده عالی استفاده می شوند.
(4) کف و شستشو
هیچ ارتباط مستقیمی بین فوم و اثربخشی شستشو وجود ندارد و میزان کف آن نشان دهنده اثربخشی شستشو نیست. به عنوان مثال ، سورفاکتانت های غیر یونی نسبت به صابون ها به مراتب کمتری دارند ، اما آلودگی آنها بسیار بهتر از صابون ها است.
در بعضی موارد ، فوم می تواند در از بین بردن خاک و آهک مفید باشد. به عنوان مثال ، هنگام شستن ظرف ها در خانه ، کف مواد شوینده قطرات روغن را جمع می کند و هنگام شستشوی فرش ها ، کف به انتخاب گرد و غبار ، پودر و سایر خاکهای جامد کمک می کند. علاوه بر این ، فوم گاهی می تواند به عنوان نشانه ای از اثربخشی یک ماده شوینده استفاده شود. از آنجا که روغنهای چرب تأثیر مهار کننده ای بر روی فوم مواد شوینده دارند ، هنگامی که روغن بیش از حد و مواد شوینده بسیار کمی وجود دارد ، هیچ کف تولید نمی شود یا کف اصلی از بین می رود. از کف نیز می توان به عنوان شاخصی از تمیز بودن شستشو استفاده کرد ، زیرا با کاهش مواد شوینده میزان کف در محلول شستشو کاهش می یابد ، بنابراین می توان از مقدار کف برای ارزیابی میزان شستشو استفاده کرد.
به معنای گسترده ، شستشو فرایند از بین بردن اجزای ناخواسته از شیء برای شستشو و دستیابی به برخی از اهداف است. شستشوی به معنای معمول به روند از بین بردن خاک از سطح حامل اشاره دارد. در شستشوی ، تعامل بین خاک و حامل با عملکرد برخی از مواد شیمیایی (به عنوان مثال ، مواد شوینده و غیره) تضعیف یا از بین می رود ، به طوری که ترکیب خاک و حامل به ترکیب خاک و مواد شوینده تغییر می یابد و در نهایت خاک از حامل جدا می شود. از آنجا که اشیاء شسته شده و خاک که باید از بین برود متنوع است ، شستشو یک فرآیند بسیار پیچیده است و می توان روند اساسی شستشو را در روابط ساده زیر بیان کرد.
Carrie · · خاک + مواد شوینده = حامل + خاک · مواد شوینده
روند شستشو معمولاً به دو مرحله تقسیم می شود: اولا ، تحت عمل مواد شوینده ، خاک از حامل آن جدا می شود. ثانیا ، خاک جدا شده در محیط پراکنده و به حالت تعلیق در می آید. روند شستشو یک روند برگشت پذیر است و ممکن است خاک پراکنده و معلق در محیط نیز از محیط به شیء شسته شده مجدداً پیش بینی شود. بنابراین ، یک ماده شوینده خوب باید علاوه بر توانایی حذف خاک از حامل ، توانایی پراکندگی و تعلیق خاک و جلوگیری از تغییر مجدد خاک را داشته باشد.
(1) انواع خاک
حتی برای همان مورد ، نوع ، ترکیب و میزان خاک بسته به محیطی که در آن استفاده می شود می تواند متفاوت باشد. خاک روغن روغن عمدتا برخی از روغن های حیوانات و گیاهی و روغنهای معدنی (مانند روغن خام ، روغن سوخت ، تار ذغال سنگ و غیره) است ، خاک جامد عمدتا دوده ، خاکستر ، زنگ زدگی ، کربن سیاه و غیره است. خاک از مواد غذایی ، مانند لکه های میوه ، لکه های روغن پخت ، لکه های چاشنی ، نشاسته و غیره. خاک از مواد آرایشی ، مانند رژ لب ، لاک ناخن و غیره. خاک از جو ، مانند دوده ، گرد و غبار ، گل و غیره. دیگران ، مانند جوهر ، چای ، پوشش و غیره در انواع مختلفی قرار می گیرند.
انواع مختلف خاک معمولاً می تواند به سه دسته اصلی تقسیم شود: خاک جامد ، خاک مایع و خاک مخصوص.
① خاک جامد
خاک جامد رایج شامل ذرات خاکستر ، گل ، زمین ، زنگ زدگی و کربن سیاه است. بیشتر این ذرات بار الکتریکی روی سطح خود دارند که بیشتر آنها با بار منفی هستند و به راحتی می توانند روی وسایل فیبر جذب شوند. به طور کلی خاک جامد برای حل آب دشوار است ، اما می تواند با راه حل های مواد شوینده پراکنده و به حالت تعلیق درآید. کثیفی جامد با نقطه جرم کوچکتر از بین بردن دشوارتر است.
② خاک مایع
خاک مایع بیشتر محلول در روغن است ، از جمله روغنهای گیاهی و حیوانات ، اسیدهای چرب ، الکل های چرب ، روغنهای معدنی و اکسیدهای آنها. در میان آنها ، روغن های گیاهی و حیوانات ، اسیدهای چرب و صابون سازی قلیایی می توانند رخ دهند ، در حالی که الکل های چرب ، روغنهای معدنی توسط قلیایی ها صابون نمی شوند ، اما می توانند در الکلها ، اترها و حلال های آلی هیدروکربن محلول باشند و محلول آب مواد شوینده امولسیون و پراکندگی. خاک مایع محلول در روغن به طور کلی دارای نیروی قوی با وسایل فیبر است و محکم تر روی الیاف جذب می شود.
③ خاک ویژه
خاک ویژه شامل پروتئین ها ، نشاسته ، خون ، ترشحات انسانی مانند عرق ، سبوم ، ادرار و آب میوه و آب چای است. بیشتر این نوع کثیفی ها می توانند از نظر شیمیایی و به شدت روی وسایل فیبر جذب شوند. بنابراین ، شستن دشوار است.
انواع مختلف خاک به ندرت به تنهایی یافت می شود ، اما اغلب با هم مخلوط می شوند و روی جسم جذب می شوند. خاک گاهی اوقات می توان با تأثیرات خارجی اکسیده ، تجزیه یا پوسیده شد و در نتیجه خاک جدید ایجاد کرد.
(2) چسبندگی خاک
لباس ، دست و غیره می تواند رنگ آمیزی شود زیرا نوعی تعامل بین جسم و خاک وجود دارد. خاک از طرق مختلف به اشیاء می پیوندد ، اما چیزی بیش از چسبندگی های فیزیکی و شیمیایی وجود ندارد.
چسبندگی دوده ، گرد و غبار ، گل ، شن و ماسه و ذغال به لباس چسبندگی فیزیکی است. به طور کلی ، از طریق این چسبندگی خاک ، و نقش بین جسم رنگ آمیزی نسبتاً ضعیف است ، حذف خاک نیز نسبتاً آسان است. به گفته نیروهای مختلف ، چسبندگی فیزیکی خاک را می توان به چسبندگی مکانیکی و چسبندگی الکترواستاتیک تقسیم کرد.
پاسخ: چسبندگی مکانیکی
این نوع چسبندگی عمدتاً به چسبندگی برخی از خاکهای جامد (به عنوان مثال ، گرد و غبار ، گل و ماسه) اشاره دارد. چسبندگی مکانیکی یکی از اشکال ضعیف تر چسبندگی خاک است و تقریباً با وسایل کاملاً مکانیکی قابل برداشت است ، اما وقتی خاک کوچک باشد (<0.1um) ، حذف آن دشوارتر است.
ب : چسبندگی الکترواستاتیک
چسبندگی الکترواستاتیک عمدتاً در عمل ذرات خاک ممتاز بر روی اشیاء با بار متضاد آشکار می شود. بیشتر اشیاء فیبری در آب منفی هستند و به راحتی می توان با استفاده از خاکهای دارای بار مثبت ، مانند انواع آهک ، به راحتی رعایت کرد. برخی از خاک ، گرچه دارای بار منفی هستند ، مانند ذرات سیاه کربن در محلول های آبی ، می توانند از طریق پل های یونی (یونهای بین چندین اشیاء با بار متضاد ، با آنها به صورت پل مانند) که توسط یونهای مثبت در آب تشکیل شده اند ، به الیاف پایبند باشند.
عمل الکترواستاتیک قوی تر از عملکرد مکانیکی ساده است و باعث می شود که حذف خاک نسبتاً دشوار باشد.
② چسبندگی شیمیایی
چسبندگی شیمیایی به پدیده خاک که بر روی یک شیء از طریق پیوندهای شیمیایی یا هیدروژن عمل می کند ، اشاره دارد. به عنوان مثال ، خاک جامد قطبی ، پروتئین ، زنگ زدگی و چسبندگی دیگر بر روی وسایل فیبر ، الیاف حاوی کربوکسیل ، هیدروکسیل ، آمید و سایر گروه ها ، این گروه ها و اسیدهای چرب خاک روغنی ، الکل های چرب به راحتی می توانند پیوندهای هیدروژن ایجاد کنند. نیروهای شیمیایی به طور کلی قوی هستند و بنابراین خاک محکم تر به جسم پیوند می یابد. حذف این نوع خاک با استفاده از روشهای معمول دشوار است و برای مقابله با آن به روشهای خاصی نیاز دارد.
میزان چسبندگی خاک به ماهیت خود خاک و ماهیت شیء که به آن چسبیده است مربوط می شود. به طور کلی ، ذرات به راحتی به موارد فیبری پایبند هستند. هرچه بافت خاک جامد کوچکتر باشد ، چسبندگی قوی تر می شود. خاک قطبی روی اشیاء آبگریز مانند پنبه و شیشه به شدت بیشتر از خاک غیر قطبی می چسبند. خاک غیر قطبی به شدت بیشتر از خاک قطبی مانند چربی های قطبی ، گرد و غبار و خاک رس می چسبد و از بین بردن و تمیز کردن آن آسان تر است.
(3) مکانیسم حذف خاک
هدف شستشو از بین بردن خاک است. در یک محیط با دمای خاص (عمدتا آب). با استفاده از اثرات مختلف فیزیکی و شیمیایی مواد شوینده برای تضعیف یا از بین بردن اثر خاک و اشیاء شسته شده ، تحت عمل نیروهای مکانیکی خاص (مانند مالش دست ، آشفتگی ماشین لباسشویی ، ضربه آب) ، به طوری که خاک و اشیاء شسته شده از هدف آلودگی.
① مکانیسم حذف خاک مایع
A : خیس کردن
مایع مایع بیشتر مبتنی بر روغن است. لکه های روغن بیشتر وسایل فیبری را خیس کرده و کم و بیش به عنوان یک فیلم روغن روی سطح مواد فیبری پخش می شود. اولین قدم در عمل شستشو ، خیس شدن سطح توسط مایع شستشو است. به خاطر تصویر ، سطح فیبر را می توان به عنوان یک سطح جامد صاف تصور کرد.
ب: جدا شدن روغن - مکانیسم فرش
مرحله دوم در عمل شستشو ، حذف روغن و گریس است ، حذف خاک مایع با نوعی سیم پیچ حاصل می شود. خاک مایع در ابتدا بر روی سطح به شکل یک فیلم روغن پخش شده وجود داشت ، و تحت تأثیر مرطوب کننده ترجیحی مایع شستشو بر روی سطح جامد (به عنوان مثال ، سطح فیبر) ، گام به گام به مهره های روغن پیچیده می شود ، که توسط مایع شستشو جایگزین شده و در نهایت سطح زیر نیروهای خارجی را ترک می کند.
② مکانیسم حذف خاک جامد
حذف خاک مایع عمدتاً از طریق مرطوب کننده ترجیحی حامل خاک توسط محلول شستشو انجام می شود ، در حالی که مکانیسم حذف خاک جامد متفاوت است ، جایی که روند شستشو عمدتاً در مورد مرطوب شدن جرم خاک و سطح حامل آن توسط محلول شستشو است. با توجه به جذب سورفاکتانتها بر روی خاک جامد و سطح حامل آن ، تعامل بین خاک و سطح کاهش می یابد و استحکام چسبندگی جرم خاک بر روی سطح کاهش می یابد ، بنابراین جرم خاک به راحتی از سطح حامل خارج می شود.
علاوه بر این ، جذب سورفاکتانتها ، به ویژه سورفکتانتهای یونی ، بر روی سطح خاک جامد و حامل آن پتانسیل افزایش پتانسیل سطح روی سطح خاک جامد و حامل آن را دارد که این امر برای حذف خاک نیز بیشتر است. سطوح جامد یا به طور کلی فیبری معمولاً در محیط های آبی منفی بار منفی می شوند و بنابراین می توانند لایه های الکترونیکی مضاعف پراکنده را بر روی توده های خاک یا سطوح جامد تشکیل دهند. با توجه به دافع بارهای همگن ، چسبندگی ذرات خاک در آب به سطح جامد تضعیف می شود. هنگامی که یک سورفاکتانت آنیونی اضافه می شود ، زیرا می تواند به طور همزمان پتانسیل سطح منفی ذرات خاک و سطح جامد را افزایش دهد ، دافع بین آنها افزایش می یابد ، مقاومت چسبندگی ذرات کاهش می یابد و از بین می رود.
سورفاکتانتهای غیر یونی بر روی سطوح جامد به طور کلی شارژ جذب می شوند و اگرچه پتانسیل سطحی را به طور قابل توجهی تغییر نمی دهند ، اما سورفاکتانتهای غیر یونی جذب شده تمایل دارند ضخامت خاصی از لایه جذب شده روی سطح را تشکیل دهند که به جلوگیری از تغییر مجدد خاک کمک می کند.
در مورد سورفاکتانتهای کاتیونی ، جذب آنها پتانسیل سطح منفی جرم خاک و سطح حامل آن را کاهش یا از بین می برد ، که باعث کاهش دفع بین خاک و سطح می شود و بنابراین منجر به حذف خاک نمی شود. علاوه بر این ، پس از جذب بر روی سطح جامد ، سورفاکتانتهای کاتیونی تمایل به تبدیل آبگریز سطح جامد دارند و بنابراین منجر به مرطوب شدن سطح و در نتیجه شستشو نمی شوند.
③ حذف خاکهای خاص
پروتئین ، نشاسته ، ترشحات انسانی ، آب میوه ، آب چای و سایر کثیفی ها با استفاده از سورفاکتانت های طبیعی دشوار است و به درمان خاصی نیاز دارند.
لکه های پروتئینی مانند خامه ، تخم مرغ ، خون ، شیر و دفع پوست تمایل به انعقاد الیاف و دژنراسیون و چسبندگی قوی تر دارند. با استفاده از پروتئازها می توان خیساندن پروتئین را حذف کرد. پروتئاز آنزیم پروتئین های موجود در خاک را به اسیدهای آمینه محلول در آب یا الیگوپپتیدها تجزیه می کند.
لکه های نشاسته به طور عمده از مواد غذایی ناشی می شود ، سایر مواردی مانند گراوی ، چسب و غیره. آمیلاز اثر کاتالیزوری بر هیدرولیز لکه های نشاسته دارد و باعث می شود نشاسته به قند شکسته شود.
لیپاز تجزیه تری گلیسیریدها را کاتالیز می کند ، که از بین بردن روشهای طبیعی مانند سبوم و روغنهای خوراکی دشوار است و آنها را به گلیسرول محلول و اسیدهای چرب می شکند.
برخی از لکه های رنگی از آب میوه ها ، آب میوه های چای ، جوهر ، رژ لب و غیره اغلب تمیز کردن کامل حتی پس از شستشوی مکرر دشوار است. این لکه ها را می توان با یک واکنش ردوکس با یک ماده اکسید کننده یا کاهش دهنده مانند سفید کننده برداشته و ساختار گروههای تولید کننده رنگ یا رنگ آمیزی را از بین می برد و آنها را به مؤلفه های محلول در آب کوچکتر تخریب می کند.
(4) مکانیسم حذف لکه های تمیز کردن خشک
موارد فوق در واقع برای آب به عنوان رسانه شستشو است. در حقیقت ، با توجه به انواع مختلف لباس و ساختار ، برخی از لباس ها با استفاده از شستشوی آب مناسب نیست یا تمیز کردن آن آسان نیست ، برخی از لباس ها بعد از شستشو و حتی تغییر شکل ، محو شدن و غیره ، به عنوان مثال: بیشتر الیاف طبیعی آب را جذب می کنند و به راحتی متورم می شوند ، و خشک و آسان برای کوچک شدن ، بنابراین بعد از شستشو تغییر شکل می یابد. با شستشوی محصولات پشم نیز اغلب پدیده کوچک شدن به نظر می رسد ، برخی از محصولات پشمی با شستشوی آب نیز به راحتی قابل استفاده هستند ، تغییر رنگ. برخی از احساس دست ابریشمی پس از شستشو بدتر می شوند و درخشش خود را از دست می دهند. برای این لباس ها اغلب از روش تمیز کردن خشک برای ضد عفونی استفاده می کنند. به اصطلاح تمیز کردن خشک به طور کلی به روش شستشو در حلال های آلی ، به ویژه در حلال های غیر قطبی اشاره دارد.
تمیز کردن خشک نوعی شستشو تر از شستشوی آب است. از آنجا که تمیز کردن خشک به عملکرد مکانیکی زیادی احتیاج ندارد ، باعث آسیب ، چروک و تغییر شکل در لباس نمی شود ، در حالی که مواد تمیز کننده خشک بر خلاف آب ، به ندرت باعث گسترش و انقباض می شوند. تا زمانی که این فناوری به درستی اداره شود ، می توان لباس ها را بدون تحریف ، محو شدن رنگ و عمر خدمات طولانی تمیز کرد.
از نظر تمیز کردن خشک ، سه نوع خاک وجود دارد.
خاک های محلول در روغن محلول در محلول در محلول شامل انواع روغن و گریس هستند که مایع یا چرب است و می تواند در حلال های تمیز کننده خشک حل شود.
② محلول در آب محلول در آب محلول در محلول در محلول های آبی محلول است ، اما در مواد تمیز کننده خشک نیست ، روی لباس در حالت آبی جذب می شود ، آب پس از رسوب مواد جامد دانه ای مانند نمک های معدنی ، نشاسته ، پروتئین و غیره تبخیر می شود.
روغن و آب محلول در محلول در محلول و آب غیر محلول در آب نه محلول در آب است و نه در حلال های تمیز کننده خشک مانند سیاه کربن ، سیلیکات فلزات و اکسیدهای مختلف و غیره محلول است.
با توجه به ماهیت متفاوت انواع مختلف خاک ، روش های مختلفی برای از بین بردن خاک در فرآیند تمیز کردن وجود دارد. خاک های محلول در روغن ، مانند روغن های حیوانی و گیاهی ، روغنهای معدنی و گریس ها ، در حلال های آلی به راحتی محلول هستند و در تمیز کردن خشک راحت تر از بین می روند. حلالیت عالی حلال های تمیز کردن خشک برای روغن ها و گریس ها اساساً از نیروهای دیواره ون der بین مولکول ها ناشی می شود.
برای از بین بردن خاکهای محلول در آب مانند نمکهای معدنی ، قندها ، پروتئین ها و عرق ، مقدار مناسب آب نیز باید به ماده تمیز کننده خشک اضافه شود ، در غیر این صورت خاک محلول در آب برای از بین بردن لباس دشوار است. با این حال ، حل شدن آب در ماده تمیز کننده خشک دشوار است ، بنابراین برای افزایش میزان آب ، شما نیز باید سورفاکتانت ها را اضافه کنید. وجود آب در ماده تمیز کننده خشک می تواند سطح خاک و لباس را هیدراته کند ، به طوری که با گروه های قطبی سورفاکتانت ها ، که منجر به جذب سورفاکتانت ها بر روی سطح است ، می توان در تعامل با گروه های قطبی سورفاکتانت ها آسان شد. علاوه بر این ، هنگامی که سورفاکتانت ها میسل را تشکیل می دهند ، می توان خاک محلول در آب و آب را در میسل حل کرد. علاوه بر افزایش محتوای آب حلال تمیز کردن ، سورفاکتانت ها همچنین می توانند در جلوگیری از استفاده مجدد از خاک برای تقویت اثر آلودگی نقش داشته باشند.
وجود مقدار کمی آب برای از بین بردن خاک محلول در آب ضروری است ، اما آب بیش از حد می تواند باعث تحریف و چروکیدن در بعضی از لباس ها شود ، بنابراین مقدار آب موجود در ماده تمیز کننده خشک باید متوسط باشد.
خاک که نه محلول در آب و نه محلول در روغن ، ذرات جامد مانند خاکستر ، گل ، زمین و کربن سیاه است ، به طور کلی توسط نیروهای الکترواستاتیک یا در ترکیب با روغن به لباس وصل می شود. در تمیز کردن خشک ، جریان حلال ، ضربه می تواند باعث جذب نیروی الکترواستاتیک از خاک خاموش شود ، و ماده تمیز کننده خشک می تواند روغن را حل کند ، به طوری که ترکیبی از روغن و خاک و متصل به لباس ذرات جامد که در ماده تمیز کننده خشک ، ماده تمیز کننده خشک در یک مقدار کمی از آب و آب و هوای خود قرار دارد ، می تواند بوی شیری را از بین ببرد. لباس
(5) عوامل مؤثر بر عمل شستشو
جذب جهت سورفاکتانتها در رابط و کاهش تنش سطح (سطحی) عوامل اصلی در حذف خاک مایع یا جامد است. با این حال ، روند شستشو پیچیده است و اثر شستشو ، حتی با همان نوع مواد شوینده ، تحت تأثیر بسیاری از عوامل دیگر قرار دارد. این عوامل شامل غلظت مواد شوینده ، دما ، ماهیت خیساندن ، نوع فیبر و ساختار پارچه است.
غلظت سورفاکتانت
میسل های سورفاکتانت ها در محلول نقش مهمی در روند شستشو دارند. هنگامی که غلظت به غلظت میسل بحرانی (CMC) می رسد ، اثر شستشو به شدت افزایش می یابد. بنابراین ، غلظت مواد شوینده در حلال باید از مقدار CMC بالاتر باشد تا اثر شستشوی خوبی داشته باشد. با این حال ، هنگامی که غلظت سورفاکتانت بالاتر از مقدار CMC باشد ، افزایش افزایشی اثر شستشو آشکار نیست و لازم نیست غلظت سورفاکتانت را بیش از حد افزایش دهید.
هنگام از بین بردن روغن با حلالیت ، اثر حلالیت با افزایش غلظت سورفاکتانت ، حتی اگر غلظت بالاتر از CMC باشد ، افزایش می یابد. در این زمان ، توصیه می شود از مواد شوینده به روشی متمرکز محلی استفاده کنید. به عنوان مثال ، اگر خاک زیادی روی دکمه های دکمه ای و یقه یک پوشاک وجود داشته باشد ، می توان لایه ای از مواد شوینده را در حین شستشو اعمال کرد تا اثر حل کننده سورفاکتانت روی روغن را افزایش دهد.
temperature تأثیر بسیار مهمی در عمل آلودگی دارد. به طور کلی ، افزایش دما باعث از بین رفتن خاک می شود ، اما گاهی اوقات درجه حرارت بیش از حد زیاد می تواند باعث مضراتی شود.
افزایش دما باعث انتشار خاک می شود ، گریس جامد به راحتی در دمای بالاتر از نقطه ذوب آن امولسیون می شود و الیاف به دلیل افزایش دما افزایش می یابد ، که همه اینها حذف خاک را تسهیل می کند. با این حال ، برای پارچه های جمع و جور ، با گسترش الیاف ، میکروگپس بین الیاف کاهش می یابد ، که برای حذف خاک مضر است.
تغییرات دما همچنین بر حلالیت ، مقدار CMC و اندازه میسل سورفاکتانتها تأثیر می گذارد ، بنابراین بر اثر شستشو تأثیر می گذارد. حلالیت سورفاکتانت ها با زنجیرهای کربن طولانی در دماهای پایین کم است و گاهی اوقات حلالیت حتی از مقدار CMC پایین تر است ، بنابراین دمای شستشو باید به طور مناسب افزایش یابد. تأثیر دما بر مقدار CMC و اندازه میسل برای سورفاکتانت های یونی و غیر یونی متفاوت است. برای سورفاکتانت های یونی ، افزایش دما به طور کلی مقدار CMC را افزایش می دهد و اندازه میسل را کاهش می دهد ، به این معنی که غلظت سورفاکتانت در محلول شستشو باید افزایش یابد. برای سورفاکتانتهای غیر یونی ، افزایش دما منجر به کاهش مقدار CMC و افزایش قابل توجه در حجم میسل می شود ، بنابراین مشخص است که افزایش مناسب دما به سورفکتانت غیر یونی کمک می کند تا اثر فعال سطح خود را اعمال کند. با این حال ، دما نباید از نقطه ابر آن تجاوز کند.
به طور خلاصه ، دمای بهینه شستشو به فرمولاسیون مواد شوینده و شیء شسته شده بستگی دارد. برخی از مواد شوینده در دمای اتاق اثر مواد شوینده خوبی دارند ، در حالی که برخی دیگر بین شستشوی سرما و گرم مواد شوینده بسیار متفاوتی دارند.
③ کف
مرسوم است که قدرت کف سازی را با اثر شستشو اشتباه گرفته و معتقد است که مواد شوینده با قدرت کف سازی زیاد اثر شستشوی خوبی دارند. تحقیقات نشان داده است که هیچ رابطه مستقیمی بین اثر شستشو و میزان کف وجود ندارد. به عنوان مثال ، شستشو با مواد شوینده کف کم نسبت به شستشوی مواد شستشوی کف کف کار مؤثر نیست.
اگرچه فوم به طور مستقیم با شستشو مرتبط نیست ، اما مواردی وجود دارد که به عنوان مثال هنگام شستن ظرف ها با دست کمک می کند. هنگام شستشوی فرش ، کف نیز می تواند گرد و غبار و سایر ذرات خاک جامد را از بین ببرد ، بخش بزرگی از گرد و غبار را به خود اختصاص می دهد ، بنابراین مواد تمیز کننده فرش باید از توانایی خاص کف استفاده کنند.
قدرت کف نیز برای شامپوها مهم است ، جایی که کف ریز تولید شده توسط مایع در هنگام شامپو یا استحمام باعث می شود موها احساس روانکاری و راحت کنند.
④ انواع الیاف و خصوصیات فیزیکی منسوجات
علاوه بر ساختار شیمیایی الیاف ، که بر چسبندگی و برداشتن خاک تأثیر می گذارد ، ظاهر الیاف و سازماندهی نخ و پارچه تأثیر در سهولت برداشتن خاک دارد.
مقیاس الیاف پشم و روبان های مسطح خمیده الیاف پنبه بیشتر از الیاف صاف کثیفی را جمع می کنند. به عنوان مثال ، کربن سیاه رنگ آمیزی شده بر روی فیلم های سلولز (فیلم های ویسکوز) به راحتی از بین می رود ، در حالی که کربن سیاه رنگ آمیزی شده بر روی پارچه های پنبه ای برای شستن دشوار است. مثال دیگر این است که پارچه های فیبر کوتاه ساخته شده از پلی استر بیشتر از پارچه های فیبر بلند مستعد تجمع لکه های روغن هستند و لکه های روغن روی پارچه های فیبر کوتاه نیز از بین بردن لکه های روغن روی پارچه های فیبر بلند دشوارتر است.
نخهای محکم و پارچه های محکم ، به دلیل فاصله اندک بین الیاف ، می توانند در برابر تهاجم خاک مقاومت کنند ، اما همین امر می تواند باعث جلوگیری از مایع شستشو شود تا خاک داخلی را از بین ببرد ، بنابراین پارچه های محکم شروع به مقاومت در برابر خاک می کنند ، اما یک بار رنگ آمیزی شستشو نیز دشوارتر است.
⑤ سختی آب
غلظت Ca2+ ، Mg2+ و سایر یون های فلزی موجود در آب تأثیر زیادی در اثر شستشو دارد ، به خصوص هنگامی که سورفکتانتهای آنیونی با یونهای Ca2+ و Mg2+ که نمک های کلسیم و منیزیم را تشکیل می دهند که کمتر محلول هستند و مواد شوینده آن را کاهش می دهد ، برخورد می کند. در آب سخت ، حتی اگر غلظت سورفاکتانت زیاد باشد ، مواد مخدر هنوز هم بسیار بدتر از تقطیر است. برای اینکه سورفاکتانت بهترین اثر شستشو را داشته باشد ، غلظت یون های Ca2 در آب باید به 1 10 10-6 مول در لیتر (CACO3 به 0.1 میلی گرم در لیتر) یا کمتر کاهش یابد. این امر مستلزم اضافه شدن نرم کننده های مختلف به مواد شوینده است.
زمان پست: فوریه 25-2022



